缩合单宁在反刍动物生产中的作用:进展,局限性和未来方向
单宁酸(饲用单宁酸)是植物中最丰富的多酚化合物之一。单宁在自然界中以多种化学独特的形式存在。根据化学结构,最常见的单宁通常分为两大类:可水解(HT)或缩合单宁(CT)。可水解的单宁是与多元醇核(通常为葡萄糖)连接的没食子酸酯或鞣花酸的酯。缩合的单宁或原花色素由黄烷-3-醇亚基连接在一起形成低聚物和聚合物。HT和CT均定义为特征性结合和沉淀可溶性蛋白质的收敛性,中高分子量的多酚化合物。本文的目的是介绍CT反刍动物相互作用的最新进展,与理解和在反刍动物生产中使用CT相关的局限性,以及未来的研究需求,以进一步提高我们对CT在反刍动物生产优化中的作用的认识。缩合的单宁酸由于反刍动物的收敛性而降低了采食量,从而降低了动物的生产性能,从而给反刍动物带来了一些营养不良的问题。但是,反刍动物可以通过使瘤胃微生物缓慢适应CT的毒性作用并释放与CT结合的唾液蛋白来耐受CT。由于与必需氨基酸形成的复合物,CT的蛋白质结合能力对反刍动物有一些好处,可防止反刍动物在瘤胃中降解,但可将其释放到下部肠道以供动物吸收。最近的数据表明,将CT给予成长中的动物时,N保留量增加。由于CT和HT具有抑制卵孵化和胃肠道线虫寄生虫幼虫运动的能力,因此具有潜在的益处,尤其是在小型反刍动物中。缩合的单宁还与矿物质(Al,Ca,Co,Cu,Fe,Mg,Mn,P和Zn)结合。尽管反刍动物的研究一直是自相矛盾的,但据报道,由于CT-金属离子络合物在很宽的pH范围内是稳定的,因此CT可能会降低矿物质的生物利用度。通过饲喂CT缓解甲烷可能是反刍动物生产最有影响的好处。已经开发了许多经验公式来预测瘤胃甲烷排放量,但很少包括CT。未来的研究应侧重于评估CT生物活性,与其他植物特定代谢物相互作用的方法的改进,
关键词: 驱虫药;驱虫药 旁路蛋白 可水解单宁 甲烷 多酚; 原花青素
介绍
单宁(饲用单宁酸)是植物多酚的一个亚类,与其他多酚的区别在于它们与蛋白质形成复合物并使其沉淀的能力(Hagerman和Butler,1978; Hagerman,2012)。传统上,常见的单宁大致分为两类:可水解(HT)和缩合单宁(CT),它们的结构明显不同。尽管单宁以结合蛋白质的能力为主要特征,但早在1930年代的报道就以“单宁的涩味以及它们与石灰,乙酸铅,生物碱,明胶的许多沉淀反应为基础描述了单宁。 ,白蛋白和其他蛋白质,以及它们与铁盐的显色反应”(Maitland等,1936年)。今天,与单宁酸和有机化合物或微量元素的许多相互作用仍然在农业研究中引起人们的兴趣,特别是在涉及它们对动物生产的潜在影响的情况下。这可能是由于与动物生理和营养中的单宁相互作用有关的确切答案相关的许多挑战和局限性。显而易见的是,要进一步了解单宁在动物生产中的用途,就需要更好地了解单宁化学在动物相互作用中的作用。也许这在1920年代很明显,当时科德宝(Freudenberg)提出了单宁的分类方案,包括HT,CT和未分类的单宁组(Maitland等,1936年。),后者表明单宁结构的存在尚未得到很好的理解。
单宁的化学多样性
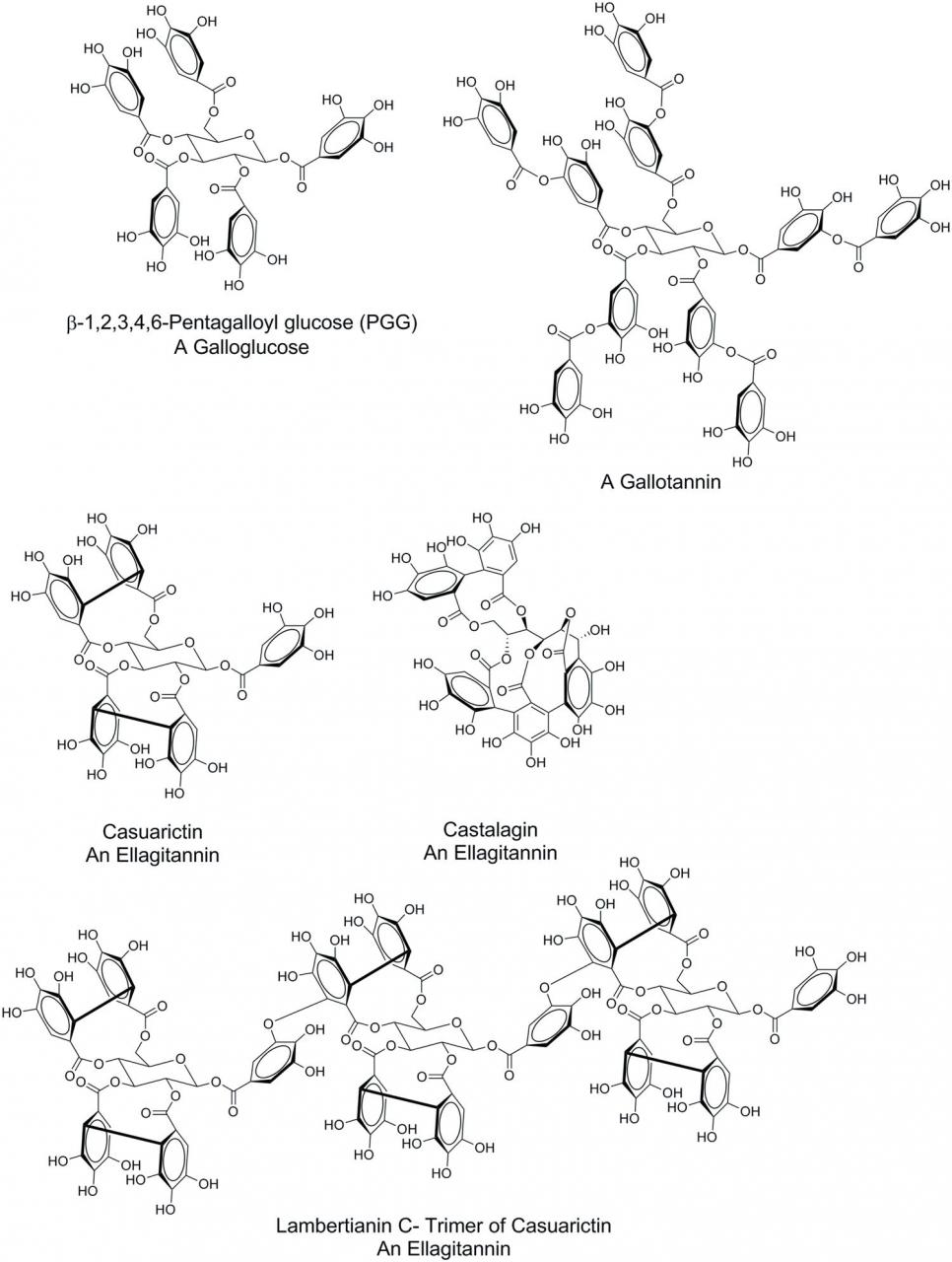
可水解单宁通常由多元醇核心分子(通常为葡萄糖)组成,但其他核心分子可包括葡萄糖醇,半乳糖,sh草酸,奎宁酸和槲皮醇(Hagerman,2011年),其核心多元醇的羟基已被没食子酸酯化。尽管是由相对简单的组件组装而成的,但HT的复杂性却通过添加随后的没食子酰基,取代的多元醇核的没食子酰基的分子内氧化偶联,葡萄糖核的开环以及通过分子间氧化偶联而使所得实体低聚而增加。根据这些化学转化产生的结构特征,HT可以分为三个主要的亚类:没食子葡萄糖苷,没食子鞣质和鞣花单宁。没食子葡萄糖是其中至少一个葡萄糖羟基已被没食子酸酯化的葡萄糖分子。该子类的一个常见代表是1,2,3,4,6-五聚葡萄糖(PGG)(图1)。没食子酸单元可以被添加到现有的没食子葡萄糖的没食子酰基基团中,这产生了没食子鞣质。没食子鞣质的经典例子是单宁酸(图1)。分子内氧化偶联使没食子酸取代基二聚,形成鞣花酸部分。这种偶联可能会在相邻的没食子酸之间发生,例如通过PGG葡萄糖C-4和C-6位置上的没食子酸酯官能团的氧化偶联,使PGG转化为Tellimagrandin II(图1)。)。反过来,可以通过将C-2和C-3上的没食子酸酯官能团氧化偶合,而得自木i素II形成木麻黄素。葡萄糖环的打开,随后进行额外的氧化偶合,产生卡斯塔拉金。这些氧化偶合也可以在分子间发生,例如通过使葡萄糖核的C-1上的没食子酰基与C-4 / C-6鞣花酸取代基偶合而形成黄柏素C,木素三聚体的三聚体。
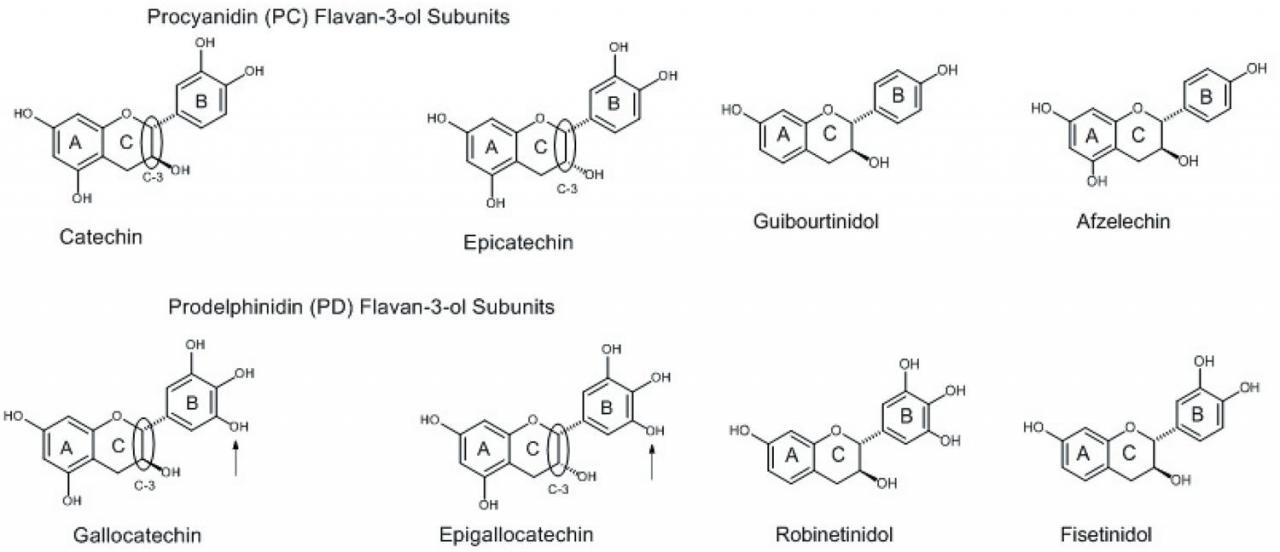
缩合单宁,也称为原花色素,由黄烷-3-醇亚基的低聚物或聚合物组成。CT中发现的flavan-3-ol亚基各不相同,但常见的包括儿茶素,表儿茶素,没食子儿茶素和表没食子儿茶素(图2)。Flavan-3-ols在羟基取代方式以及C-2和C-3 C环取代基的相对立体化学方面有所不同(在图2中圈出) )。儿茶素和表儿茶素具有相同的羟基化模式(A环的C-5和C-7上的酚取代基,B环的C-3和C-4上的酚取代基和C-3碳上的醇取代基) C环)。唯一的区别是与C环的C-3相连的取代基在空间上的相对方向。关于该关系,如果C环的C-2 / C-3取代基由两个虚线键或两个楔形键表示,则该取代基为 顺式 构型。如果一个键表示为虚线键而一个键表示为楔形键,则取代基处于 反式 构型。当存在两个或多个手性(不对称)中心时,如虚线和楔形键(图2),而只有其中一个是从一对其他结构相同的结构上反转的(从楔形变为短划线,反之亦然),该异构体称为差向异构体。因此,在C环的C-3的碳中心倒置的儿茶素称为表儿茶素。没食子儿茶素和表没食子儿茶素与儿茶素和表儿茶素的不同之处在于在B环上包含一个额外的苯酚取代基(图2中的箭头 所示))。芳环上在相邻碳原子上具有三个酚取代基的这种取代方式称为加洛取代。因此,在这种取代模式下,儿茶素变成没食子儿茶素,表儿茶素变成表没食子儿茶素。儿茶素和表儿茶素被称为原花青素(PC)亚基,因为它们在氧化时都会产生花青素。类似地,由于没食子儿茶素和表没食子儿茶素在氧化时均会产生delphinidin,因此它们被称为原没食子素(PD)亚基。
CT中还存在其他植物原料中的其他flavan-3-ol亚基,但其发生频率低于PC和PD亚基。与PC和PD亚基相比,这些flavan-3-ol亚基的羟基(OH)基数不同(图2)。这些化合物也以差向异构体的形式出现(未显示)。
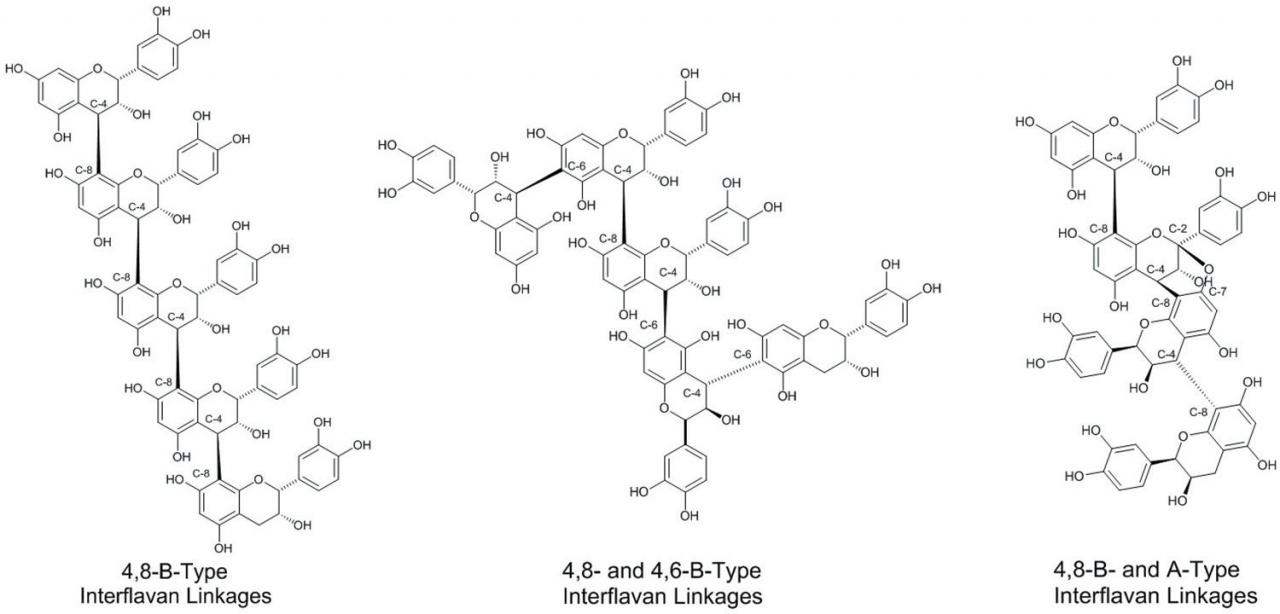
将flavan-3-ol亚基组装成CT低聚物和聚合物可通过多种类型的共价键模式进行(图3)。)。最常见的键合模式包括从一个flavan-3-ol的C环的C-4位置到随后的flavan-3-ol亚基的C-8碳或其一个C-4位置的共价键。一个flavan-3-ol的C环与随后的flavan-3-ol亚基的C-6碳。这些连接被称为B型连接,并特别标记为4→8或4→6 B型连接。第三种相对普遍的黄烷间键涉及参与的黄烷-3-醇亚基之间的两个共价键的形成。例如,除了现有的4→8 B型连接以外,还从C-7氧原子形成一个额外的共价键,从旁边参与C-8碳的碳到4的C-2碳。 →8连接了flavan-3 -ol亚基,称为4→8,2→O→7键合模式,通常称为A型黄酮键。可以在从蔓越莓中分离出的CT中找到A型连锁(Foo等,2000),花生皮( Lou等,1999)和肉桂皮( Anderson等,2004)。
水解单宁被认为对包括反刍动物在内的牲畜有毒。 Doce等。(2013年) 通过给牛饲喂Quercus pyrenaica( 一种富含HT的属)的叶子来证实这一点 ,并报告了主要在限食和营养不良的情况下,显着抑制消化作用和急性毒性症状。这可能是由于与某些CT相比,某些HT具有更高的蛋白结合活性(Jayanegara等,2015)。鉴于HT(例如punicalagin)对某些牲畜具有肝毒性和肾毒性作用(Filippich等,1991)),CT通常是与单宁-动物相互作用相关的研究重点。尽管如此,HT作为抗病毒和抗微生物化合物的未来应用(Buzzini等,2008)仍然是许多反刍动物营养学家关注的话题。
并非所有的植物物种都能产生CT。在这些反应中,浓度和化学特性变化很大。一些饲草植物,例如富含CT的豆类,通常也具有丰富的营养价值(例如蛋白质)。对于食用含CT的豆类的动物,豆类的高营养价值可能有助于抵消动物摄入高浓度的生物活性形式时经常观察到的CT的抗营养作用。
单宁浓缩(饲用单宁酸)的抗营养作用
尽管它经常被忽略或忽视,但许多具有生物活性的CT产生植物对食用它们的动物显示出抗营养作用这一事实不容忽视。但是,关于CT对动物的抗营养作用的概括是很普遍的。这些概括的例子包括日粮适口性降低,日粮CT浓度超过干物质(DM)的5%时采食量降低,营养物质(蛋白质,碳水化合物和脂肪)的消化率降低,饲料效率和动物产品产量降低。 Mueller-Harvey(2006) 为更好地理解这些抗营养反应提供了一些急需的澄清和背景。
适口性通常基于与唾液中蛋白质形成的CT-蛋白质复合物相关的涩味。因此,CT结合的蛋白质越大,涩味越大,适口性也越低。但是,并非所有的CT都能平等地结合蛋白质。例如, 与 产生较低浓度且具有更多蛋白质结合活性的CT的Neptunia lutea 或 Lespedeza cuneata相比, pansuldium paniculatum产生的CT浓度更高,显示出较低的蛋白质结合 力(Naumann等人,2014b)。这也许可以解释为什么 含有9-10%CT的洋葱Onobrychus viciifolia比莲花Lotus Corniculatus对绵羊更可口 ,其CT浓度较低,仅为2.6-4%(Haring等,2008)。摄入至少在开始时与适口性有关。当CT对蛋白质结合更有效时,摄入量可能低于DM的5%,而当CT较不有效时,摄入量可能大于DM的5%。
通过CT观察到的养分消化率下降是不一致的。例如, CT浓度在6-9%DM范围内的大叶紫苏对体内 粗蛋白(CP)或DM消化率没有负面影响 (Jin等,2012)。但是, Jayanegara等。(2015年) 观察到,将 来自不同来源且化学结构不同的CT添加到基质中时,体内有机物(OM)消化率降低 。 Theodoridou等。(2010) 观察到的凹陷瘤胃蛋白质消化率和从尿氮排泄粪便氮排泄的移位,同时保持在羊体内供给-N保持 O.刺 含有浓度为2.5-3.4%DM的CT。 诸如上述的体内 或 原位研究提供了对CT和动物营养之间关系的复杂性的深入了解和更深入的了解。
许多产生CT的植物还产生其他植物特有的代谢产物这一事实不容忽视。通常在植物或饮食中测量CT并观察动物的反应。但是,可能还有其他无法测量的代谢物导致观察到的反应。例如, 相思树 是一种豆科植物,可产生中等浓度的CT(7-9%DM)并抑制瘤胃甲烷的产生(Naumann等,2013b),结合蛋白(Naumann等,2014b)并抑制幼虫。 L3 Haemonchus contortus的迁移 (Naumann等,2014a)。单宁可能是浓缩的单宁,是在A. angustissima中发现的许多植物特有代谢产物中的一种 。,影响这些反应(McSweeney等,2008)。这些化合物单独或组合使用,有可能使动物的排毒能力不堪重负。但是,如果允许动物及其瘤胃微生物种群适应 A. angustissima,则通常会减轻或避免与该植物毒性相关的症状(Odenyo等,1997)。
微生物对CT的适应性是动物避免抗营养作用的关键保护机制之一。微生物适应性保护动物的机制尚不清楚,但可能与种群向能够改变CT的微生物转移有关(Smith等,2005)。与未经 接种的山羊相比,用半栎栎的叶片喂食的山羊 接种 了单宁降解性微生物- 解毒链球菌的活培养 物,其DM和CP消化率,ADG和饲料效率更高(Kumar等,2014)。瘤胃微生物种群向普氏杆菌的转变 。在西卡鹿(日本鹿)中被观察到 用Quercus spp。的叶片喂食 ,表明瘤胃中的条件发生了变化,从而导致了 Prevotella的生长 或 Prevotella 可能能够降解 Quercus 丹宁酸(Li等,2013)。栎 属植物中的单宁 。通常是HT而不是CT。但是, 解鸡链球菌在体外 也显示出对阿拉伯树胶 CT的抗性 (≤4%) , 而 牛链球菌的抑菌作用 被抑制在> 0.5%(O’Donovan和Brooker,2001)。是否 解毒链球菌 尚不清楚其他瘤胃微生物是否具有降解瘤胃CT的能力。需要做更多的研究来更好地了解CT如何影响瘤胃微生物种群,反之,CT如何受到瘤胃微生物种群的影响。
动物耐受CT的抗营养作用的另一个重要保护机制是动物唾液中单宁结合蛋白的产生。长期以来,富含脯氨酸的蛋白质被认为是唾液中结合饮食CT(McArthur等,1995)和HT(Cappai等,2013)的重要组成部分。最近的研究表明,CT不仅与酸性和糖基化的脯氨酸丰富的唾液蛋白相互作用,而且还与组蛋白和statherins相互作用(Soares等,2011; Soares等,2012b)。前述研究是使用人类来源的唾液进行的。很少有研究集中在反刍家畜的唾液上。目前尚不清楚反刍动物中除了富含脯氨酸的蛋白质以外还有哪些蛋白质。 痣等。(1990年) 确定了牛,猪和绵羊来源唾液中脯氨酸的浓度,并报道了牛唾液中脯氨酸的浓度最高,但都显示对单宁的亲和力低。 Alonso-Diaz等。(2012年) 报告了绵羊和山羊唾液的氨基酸谱,发现脯氨酸相对于组氨酸,精氨酸和谷氨酸而言是次要成分。此外,绵羊和山羊之间唾液蛋白对不同来源CT的亲和力也不同,这可能反映了喂养策略的差异。唾液蛋白的单宁结合能力也可能是反刍动物暂时的生理适应,以节省氮,仅当动物食用富含CT的饮食时,其产量才会增加(Vargas-Magana等,2013)。更复杂的是,其他饮食成分(例如碳水化合物)可能会抑制CT与唾液蛋白复合的能力(Soares等,2012a)。我们开始更好地了解唾液单宁结合蛋白生理的复杂性,但是仍然需要针对性研究来确定家畜(即绵羊,山羊和牛)中存在的单宁结合唾液蛋白的家族,并揭示相关的CT结合亲和力和其他饮食成分的抑制作用。
日粮中浓缩单宁和蛋白质之间的相互作用
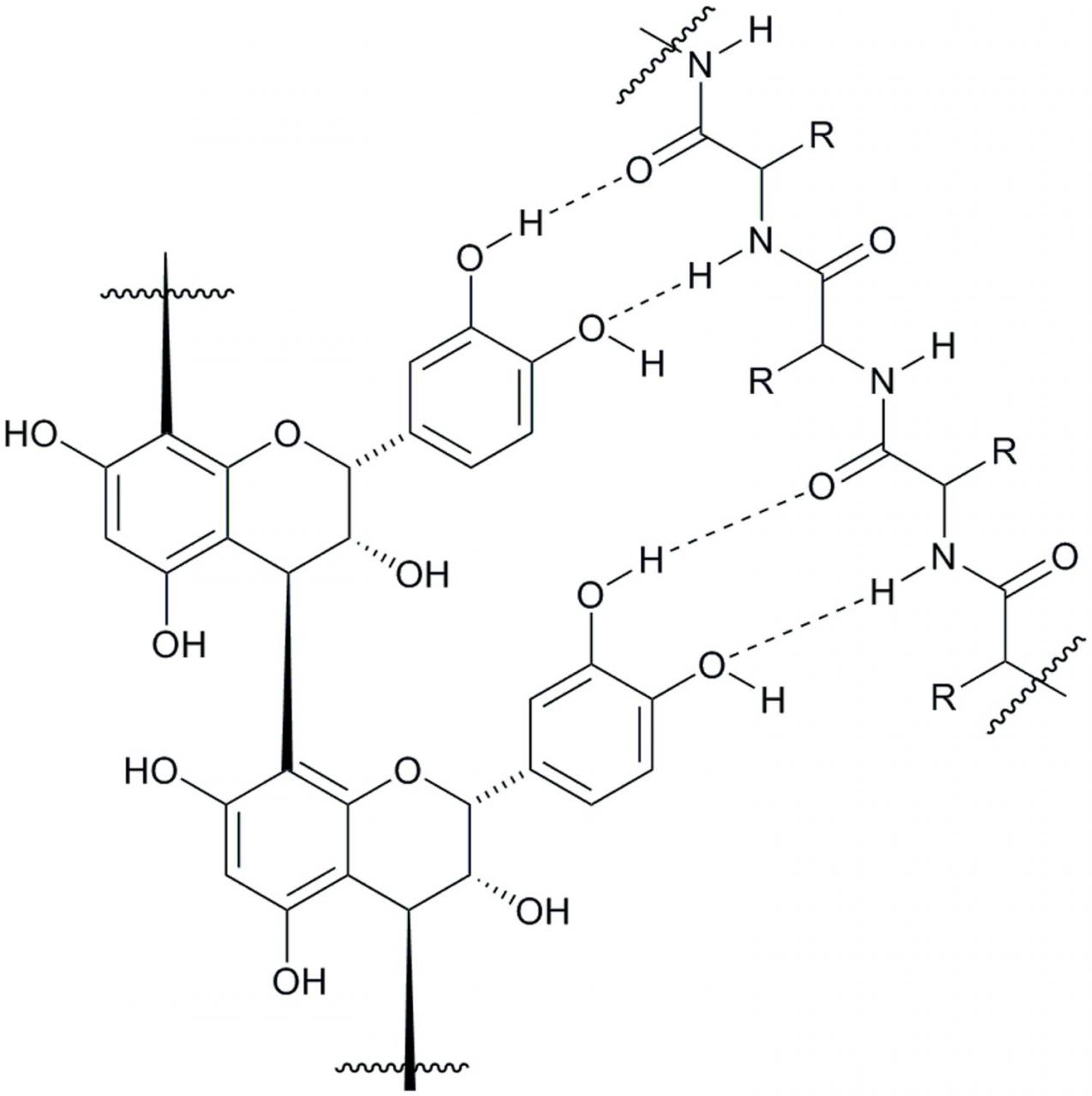
大量研究已证明CT蛋白复合和沉淀(Hagerman,2012年)。但是,由于涉及这些研究的实体的复杂性质,关于CT和蛋白质在复合物的形成和随后的沉淀中所起的控制作用和程度尚待解释很多。单宁研究人员之间的共识是,CT与蛋白质之间的氢键键合和疏水相互作用在络合和沉淀过程中均起着重要作用。尽管可以概念化地描述这些参与者之间氢键的可能性(图4),分子间疏水相互作用的复杂性不太明显。我们已经了解到,在影响单宁蛋白结合的许多因素中(Ozdal等人,2013年),CT-蛋白复合物的形成以及随后的沉淀物形成均取决于蛋白的结构(Hagerman和Robbins,1993; de Freitas)和Mateus,2002年; Lorenz等人,2014年)和CT(Poncet-Legrand等人,2006年; Lorenz等人,2014年)进行检测时,蛋白质的等电点(pI)(Hagerman和Butler,1981年) ; McNabb等,1998),研究培养基的pH值(McNabb等,1998 ; Adamczyk等,2012),以及单宁蛋白摩尔比( Hagerman等,1998 ; Charlton等,2002 ; Adamczyk等,2012)。实验证据表明,丹宁酸与蛋白质结合,通过表面吸附机制形成蛋白质的丹宁酸涂层,这可能导致丹宁酸-蛋白质复合物沉淀( Dobreva等,2011)。单宁/蛋白质比率高时,蛋白质被单宁包裹并导致其沉淀,而单宁/蛋白质比率低则促进了可溶性单宁/蛋白质复合物的相互连接,促进了复合物的聚集( Spencer等人, 1988年; Le Bourvellec和Renard,2012年),最终导致复合物沉淀。
CT-蛋白结合的效率是高度可变的(Hagerman和Butler,1981; Canon等,2011)。一旦被认为是非特异性相互作用,Perez-Gregorio等人报道的结果 。(2014年) 表明单宁蛋白结合是高度特异性的。但是,这种相互作用的特异性似乎也与单宁以及蛋白质的极性有关(Perez-Gregorio等,2014)。反刍动物营养中这种特异性的含义由于瘤胃中主要蛋白质和CT的浓度和结构特征的变化而变得复杂(Lorenz et al。,2014)以及瘤胃的pH值,后者也受到饮食的影响。饮食成分的蛋白质类型和随后的氨基酸组成以及存在的CT的结构化学和类型可能存在很大差异,导致难以根据CT-蛋白质相互作用预测特定的动物反应。 Tedeschi等。(2014年) 指出,建模是了解胃肠道CT关联的复杂性的一种方法。
为了优化生产效率,瘤胃可降解蛋白(RDP)必须与能量供应相平衡,以使微生物蛋白的合成最大化(Brooks等,2012)。瘤胃后的氨基酸组成可以通过提供瘤胃不可降解蛋白(RUP)来调节,以匹配动物的氨基酸需求(Mercen和Titgemeyer,1992; Schwab,1995)。反刍动物日粮中常见的膳食氮源(如 紫花苜蓿 和豆粕)在瘤胃中可高度降解,导致瘤胃中的氨(NH 3)浓度高,氮利用效率低,通常约为25%(Calsamiglia等,2010))。高效率的RDP降低了氮的再循环效率(Agle等,2010)并增加了血液中尿素氮(BUN)的浓度,导致效率低下,这是不合理的,这与生殖和生育问题有关(Elrod and Butler,1993 ; Westwood等。 ,2000; Roche,2006; Tshuma等,2014)。
缩合的单宁酸可能提供一种有效的策略,通过在瘤胃环境中形成稳定的复合物来保护膳食蛋白质免于降解(Patra和Saxena,2011年)。各种草料豆科植物的CT对RDP的影响已得到很好的研究,但由于不一致的实验方法,这种关系变得模糊。通常,通过降低瘤胃蛋白质降解的速率和程度(Coblentz和Grabber,2013年)和NH 3 浓度(McNabb等,1996; Min等, 2005; Agle等人,2010),增加了瘤胃后氨基酸的流量(Waghorn等人,1994b)。
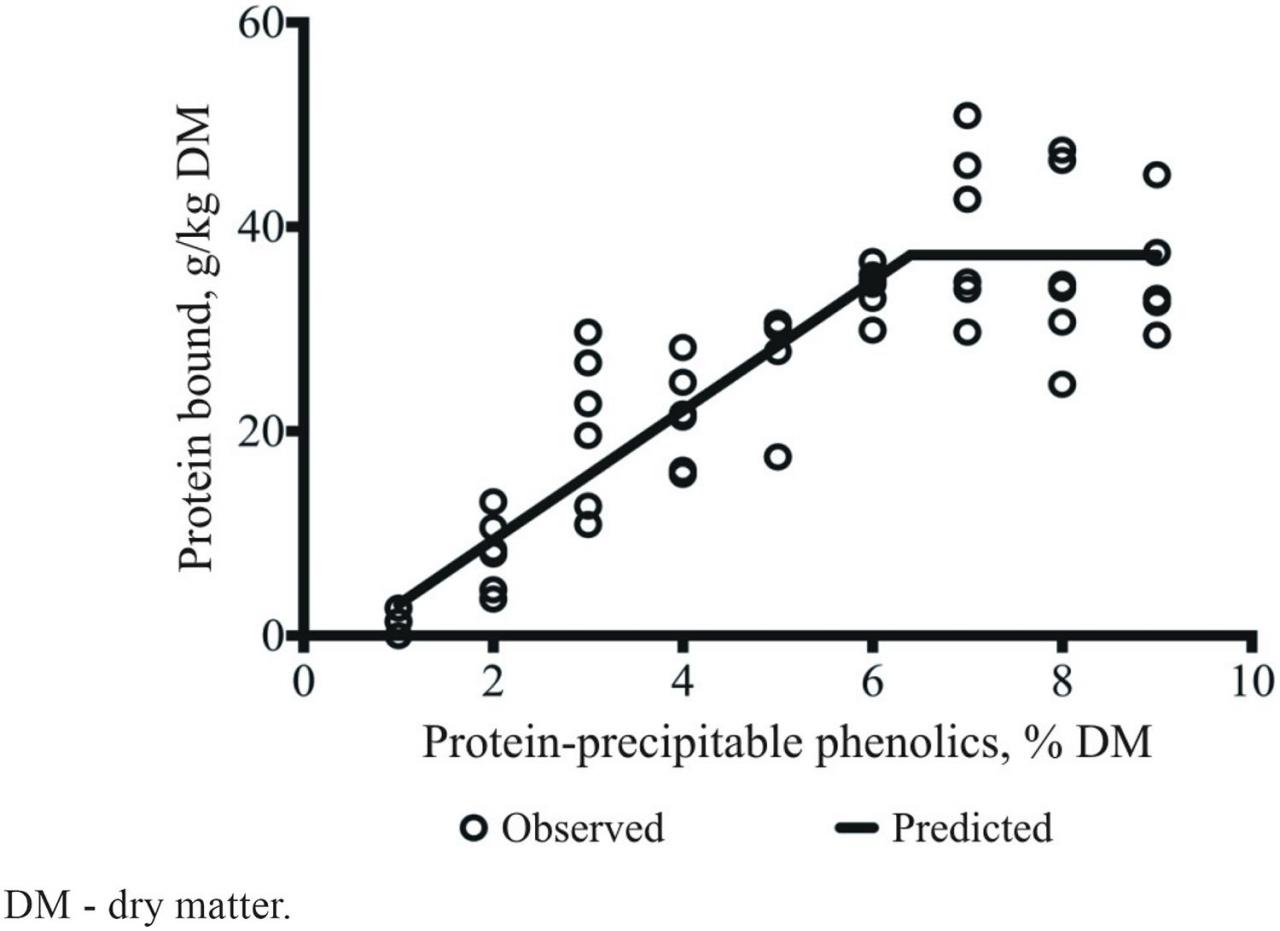
我们研究团队的结果(Naumann等人,2014c)表明,我们可以使用筛选工具根据蛋白质可沉淀的多酚浓度预测结构多样的CT混合物与蛋白质结合的潜力(图5)。线性分段回归由公式1表示 :